Kurs:Periodensystem und Atome
Das Periodensystem der Elemente (PSE)
[Bearbeiten]Einleitung
[Bearbeiten]Alles auf der Erde und im Universum besteht aus bestimmten Stoffen. Und jeder Stoff setzt sich wiederum aus "Bausteinen" zusammen. In der Chemie sind Modelle von sehr wichtiger Bedeutung, also auch hierfür ein Modell zur besseren Vorstellung: Man hat einen Sack voller Bauklötze. Jeder einzelne Bauklotz besteht natürlich wiederum aus einzelnen, zusammenliegenden Holzfasern. Die Bauklötze kann man in bestimmter Weise anordnen und sie ergeben ein schönes, tragfähiges "Bauwerk". Baut man mehrere, so ergeben sie gemeinsam eine Art Wohnsiedlung. Wenn man jedoch die Klötze falsch zusammensetzt oder auch falsch platziert, so gibt es Probleme: Das Haus stürzt ein. Ähnlich ist es auch in der Chemie: Es gibt zunächst einmal die Atome ("Bauklötze") bestimmter der über 100 Elemente (Die Bauklötze sind verschiedenfarbig). Die Elemente sind im Periodensystem der Elemente (PSE) angeordnet, in dem jedem Atom ein oder zwei "Kennbuchstaben" (erster davon immer in Großschreibung!) zugeordnet sind, damit die Namen der Stoffe hinterher nicht zu lang werden. Dazu aber auch später noch mehr. Aus den Atomen können sich wiederum Moleküle bilden ("Häuser") und ganz viele dieser Moleküle bilden eine bestimmte Menge eines Stoffes, die "Wohnsiedlung". Man könnte z.B. an Wasser denken. Wasser besteht aus 2 Wasserstoffatomen (Kennbuchstabe H) und einem Sauerstoffatom (Abkürzung O). In der Chemie wird Wasser auch als H2O bezeichnet, oder mit einem "ganzen" systematischen Namen "Dihydrogenmonooxid". Aus sehr vielen Wassermolekülen setzt sich wiederum ein Glas Wasser zusammen, was man gerne zur Erfrischung trinkt. Zur Veranschaulichung der Größe: Ein Wassermolekül wiegt gerade einmal rund 30,6/1.000.000.000.000.000.000.000.000 g - eine Tafel Schokolade wiegt 100 g, eine Packung Milch 1.000 g. Ein einziges Wassermolekül hat also nur rund 0,000000000000000000306% des Gewichts einer Tafel Schokolade!
-
Bauklötze
-
"Bauwerk"
-
Schokolade
-
Glas Ohne Wasser
Entwicklung des PSE
[Bearbeiten]Die Elemente sind die Grundbausteine aller Stoffe. Zwei Elemente solleten jetzt schon bekannt sein, nämlich Wasserstoff (H) und Sauerstoff (O). Das PSE (Periodensystem) listet nun alle (bekannten) Elemente auf - und zwar nicht irgendwie, sondern in gut überdachter Art und Weise: Anfangs waren nur einige wenige Elemente, also verschiedene Atome, überhaupt bekannt. Nach und nach wurden immer neue entdeckt und somit musste eine Systematik her, bei der alle (bekannten) Atome - nach deren Eigenschaften geordnet - zu finden sind. In den Jahren 1868 und 1869 entwickelten die Chemiker Mendelejew und Meyer unabhängig voneinander ein System, was nach dem selben System noch heutzutage das Periodensystem der Elemente, das PSE bildet.
Aufbau eines Atoms
[Bearbeiten]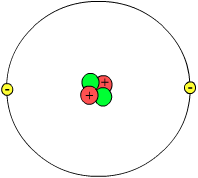
Um die Ordnung im Periodensystem besser verstehen zu können, sind jedoch noch einige weitere Infos wichtig. Bei dem "Bauklötzchen-Modell" hatte ich bereits erwähnt, dass die Holzklötze selbstverständlich nicht die kleinste Einheit der "Wohnsiedlung" bilden - jeder Holzklotz setzt sich nämlich wiederum aus einzelnen Holzfasern und aus einer bunten Lackfärbung zusammen. Genauso sieht es auch mit den Atomen aus. Der Begriff "Atom" kommt ursprünglich aus dem Griechischen von dem Begriff "atomes", zu Deutsch "unteilbar". Doch dass dies nicht stimmt, fand man erst heraus, als der schöne Begriff des Atoms schon geprägt war. Dennoch bilden Atome die kleinsten Einheiten, aus denen sich Stoffe bilden. Nur setzen sich die Atome wiederum aus noch kleineren Teilchen zusammen: den Nukleonen und den Elektronen. Das Atom setzt sich somit aus zwei Teilen zusammen: Die Nukleonen bilden den sogenannten Atomkern, um den Elektronen herumschwirren und dort die Elektronenwolke bilden. "Nukleonen" ist ein Sammelbegriff für zwei verschiedenen Arten von Kernteilchen: einerseits die Protonen, deren Anzahl das Element letztenendes ausmacht, und weiterhin die Neutronen. Diese verschiedenen "Atombausteine" haben verschiedene Ladungen, die man sich wie bei einem Magneten vorstellen kann: Bei einem Magneten ziehen sich verschiedene Pole (also Pluspol und Minuspol) an, gleiche stoßen sich jedoch ab (2 Pluspole bzw. 2 Minuspole). Die "Minuspole" des Atoms sind die Elektronen, die um den Kern herumschwirren. Protonen dienen als "Pluspole", sie sind somit positiv (+) geladen. Neutronen sind elektrisch neutral, d.h., sie haben keine Ladung und stellen eine Art "Kitt" oder "Klebstoff" dar, damit die positiv geladenen Protonen, die sich alle dicht nebeneinander im Kern aufhalten, nicht gegenseitig abstoßen wie zwei Pluspole eines Magneten. Normalerweise ist die Anzahl der Neutronen festgelegt. Jedoch sind in einem Atomkern manchmal auch mehr oder weniger Neutronen vorhanden. In diesm Fall spricht man von Isotopen. Wasserstoff beispielsweise hat 3 Isotope: zuerst die am häufigsten vorkommende Form (99%) ohne Neutronen ("Protium"). Weiterhin gibt es jedoch auch Formen des Wasserstoffs mit einem Neutron ("Deuterium") bzw. zweien ("Tritium"). Dies hat jedoch für das Element keine größere Bedeutung. Damit ein Atom - so wie es sein soll - nach außen hin elektrisch neutral ist, d.h. in seiner Gesamtheit ungeladen, muss in einem Atom die Anzahl Protonen also "Plus-Kernteilchen" und der Elektronen, sozusagen den "Minus-Kernteilchen", die in ungeheurer Geschwindigkeit um die Nukleonen im Kern (also Protonen und Neutronen) umherflitzen, gleich sein. Und genau das ist auch bei allen Elementen, wie wir sie im PSE vorfinden, der Fall.
(1 u(sprich: 1 unit[[[:Vorlage:IPA]]]) = 1,66056*10-27 kg)
| Name | Formelzeichen | genaues Gewicht | zur Vereinfachung meistens verwendet |
|---|---|---|---|
| Neutron | 1,008 664 915 79 u | 1 u | |
| Elektron | 0,000 5485 799 11 u | 0 u | |
| Proton | 1,007 276 466 88 u | 1 u |
Der Aufbau des Periodensystems der Elemente
[Bearbeiten]
Wie schon gesagt, sind im Periodensystem der Elemente alle bekannten "Grundbausteine" für die Stoffe, der verschiedenen Elemente, nach einer bestimmten Systematik angeordnet. Die Elektronen, also die negativ (-) geladenen Teilchen, die sich fortwährend um den Kern herum bewegen, ordnen sich immer in "Schichten" zu acht um den Atomkern. Im PSE gibt es zunächst einmal eine horizontale Aufteilung in Perioden. Von links nach rechts gelesen nimmt die Anzahl der Elektronen der äußeren Hülle zu, die Anzahl der Schalen/Hüllen steigt von oben nach unten. In der ersten Periode (in der sich ausschließlich Wasserstoff (H) und Helium (He) befinden) ist die sogenannte Edelgaskonfiguration bereits nach 2 Elektronen (Die Abkürzung für Elektron ist "") gefüllt. Somit besteht die erste Elektronenschale aller Elemente aus zwei anstatt acht Elektronen. ((todo: wofür stehen die Zahlen?)) Weiterhin findet eine Aufteilung in Hauptgruppen und Nebengruppen statt.
Die acht Hauptgruppen
[Bearbeiten]Es gibt 8 Hauptgruppen, die vertikal angeordnet, und mit römischen Ziffern bezeichnet sind. Jede Hauptgruppe (HG) hat einen bestimmten Namen erhalten:
- I. HG: Alkalimetalle
- II. HG: Erdalkalimetalle
- III. HG: Erdmetalle
- IV. HG: Kohlenstoff-Silicium-Gruppe
- V. HG: Stickstoff-Phosphor-Gruppe
- VI. HG: Chalkogene
- VII. HG: Halogene
- VIII. HG: Edelgase
Die Stoffe innerhalb dieser Hauptgruppen haben meist sehr ähnliche/vergleichbare Eigenschaften. Beispielsweise sind alle Alkalimetalle (I. HG) sehr reaktionsfreudig (d.h., sie verbinden sich sehr gerne mit anderen Stoffen), wogegen die Edelgase (VIII. HG) äußerst reaktionsträge sind (sie bleiben am Liebsten "für sich", warum das so ist, wird später geklärt).

Die Stoffe innerhalb der einzelnen Hauptgruppen haben die Gemeinsamkeit einer gleichen Anzahl an Elektronen in der äußersten Schicht, die jeweils der Hauptgruppennummer entspricht.
Nimmt man also beispielsweise das Element Calcium (2. HG, 4. Periode), so stellt man fest, dass Calcium 2 Elektronen auf der äußersten Schale besitzt, wobei die äußere Schale die 4. Hülle bildet.
Die Nebengruppen
[Bearbeiten]....
Bindungsarten
[Bearbeiten]Damit sich nun die einzelnen Atome zu Gruppen zusammenschließen können, muss etwas bestimmtes passieren. Jedes Atom möchte zunächst einmal die bereits erwähnte Edelgaskonfiguration erreichen, das heißt eine abgeschlossene Elektronenhülle. Je nachdem, wieviele Elektronen auf der Außenschale liegen, gibt ein Atom entweder Elektronen tendentiell eher ab, oder zieht sie eher stärker zu sich hin. Die "magische Grenze" dafür liegt bei 4 Außenelektronen, wo beides geschehen kann. So sieht man, dass beispielsweise das Alkalimetall Kalium mit nur einem Elektron auf der äußeren Schale dieses leichter abgibt als beispielsweise Bor mit drei Außenelektronen. So lässt sich auch leicht erklären, warum die Edelgase (8. Hauptgruppe) derart reaktionsträge sind: Sie haben praktisch schon alles "was sie wollen", nämlich eine gefüllte äußere Elektronenhülle und gaben so gleichzeitig der Edelgaskonfiguration ihren Namen.
Die Fähigkeit der Stärke, Elektronen zu sich hinüber zu ziehen, hat den Namen Elektronegativität oder kurz EN. Sie steigt im Periodensystem von unten links (Caesium, Cs hat den niedrigsten Wert innerhalb der Hauptgruppen mit 0,86) nach oben rechts hin (Fluor, F hat den höchsten Elektronegativitätswert mit 4,17) an. Man kann sich also vorstellen, das beispielsweise bei der Verbindung des Wassers () alle Elektronen etwas stärker zum Sauerstoff gezogen werden. Sauerstoff (EN-Wert: 3,5) und Wasserstoff (EN-Wert: 2,1) haben somit eine Elektronegativitätsdifferenz von 1,4 (3,5-2,1=1,4). Da Sauerstoff der elektronegativere Bindungspartner (also derjenige mit der höheren Elektronegativität) ist, werden die Elektronen eher zu ihm gezogen.
Man denke hier noch einmal an das bereits in der Einführung erwähnte Gesetz der Massenerhaltung in chemischen Reaktionen. Hier erscheint es nur logisch, dass keine Masse verloren geht, da schließlich alle Atome erhalten bleiben, vielleicht nur neue Bindungen eingehen und somit neue Stoffe entstehen.
Einige Elemente (z.B. Wasserstoff (), Sauerstoff (), Chlor ()) kommen ausschließlich in Molekülen, nicht jedoch als einzelne Atome vor (Im Gegensatz zu z.B. Helium, He). Solche Moleküle bezeichnet man als homonuklear, also aus nur einem Element bestehend. Fast alle Moleküle bestehen jedoch aus verschiedenen Atomen und heißen somit heteronuklear.
Atombindung
[Bearbeiten]Zunächst einmal gibt es das Modell der Atombindungen. Hier werden keine Elektronen wirklich abgegeben, die Reaktionspartner teilen sie sich lediglich.
Es gibt zwei oft verwendete Schreibweisen für Atome und Moleküle: In der Summenformel wird die Anzahl der jeweiligen Moleküle einfach als Indexzahl neben die jeweilige Elementsbezeichnung geschrieben (z.B. in oder ). Die Summenformel hat jedoch in der organischen Chemie (dem Teil der Chemie, in dem sich alles um Verbindungen mit Kohlenstoff geht) nur eine geringe Bedeutung.
Ein Atom/Molekül schreibt man aber auch oft (v.a. in der organischen Chemie) in sogenannten Strukturformeln. Dort wird die äußere Elektronenhülle um das jeweilige Molekül jeweils mit Punkten (für 1 Elektron) und Strichen (für 2 Elektronen) dargestellt. Kohlenstoffdioxid (als Summenformel ) schreibt man so z.B. folgendermaßen: ![]() Hier wird ersichtlich, dass sich das Kohlenstoffatom mit jedem Sauerstoffatom (rechts und links) je 4 Elektronen "teilt", 2 von seinen Elektronen und je zwei von den Sauerstoffatomen. Hier spricht man von einer sogenannten Doppelbindung. Somit haben alle Atome (sowohl Kohlenstoff, als auch Sauerstoff) "Anteil" an den Elektronen und eine zumindest scheinbare gefüllte äußere Elektronenhülle.
Die häufiger vorkommende Einfachbindung sieht beispielsweise folgendermaßen aus:
Hier wird ersichtlich, dass sich das Kohlenstoffatom mit jedem Sauerstoffatom (rechts und links) je 4 Elektronen "teilt", 2 von seinen Elektronen und je zwei von den Sauerstoffatomen. Hier spricht man von einer sogenannten Doppelbindung. Somit haben alle Atome (sowohl Kohlenstoff, als auch Sauerstoff) "Anteil" an den Elektronen und eine zumindest scheinbare gefüllte äußere Elektronenhülle.
Die häufiger vorkommende Einfachbindung sieht beispielsweise folgendermaßen aus:
 .
.
Eine wichtige elektrochemische Eigenschaft ist die Polarität. Das Vorhandensein von Polarität lässt sich einfach aus der bereits erwähnten Differenz der Elektronegativitäten zweier Stoffe errechnen (in den Naturwissenschaften steht der griechische Großbuchstabe Delta immer für eine Differenz, also schreibt man auch oft Δ EN). Die Grenzen sind hier relativ fließend, jedoch kann man in etwa die Grenzen für Polarität folgendermaßen festlegen:
Δ EN < 0,4 : unpolare-schwach polare Bindung
0,4 < Δ EN < 1,7 : stark polare Bindung.
Je größer also Δ EN wird, desto stärker polar ist ein Stoff, also zieht somit ein Bindungspartner in vielen Fällen stärker an den Elektronen als ein anderer. (Ist dies nicht der Fall, so nennt man die Verbindung unpolar.)
Ionenbindung
[Bearbeiten]Bei Ionenbindungen werden nun tatsächlich Elektronen an einen anderen Reaktionspartner abgegeben. Ionische Bindungen finden sich ab einer Elektronegativitätsdifferenz (Δ EN) von etwa 1,7. Hier werden die Elektronen so stark zum elektronegativeren Bindungspartner gezogen, dass sich sogenannte Ionen - geladene Teilchen - bilden. Positiv geladenen Ionen (Kationen) fehlen dann jeweils ein oder mehrere Elektronen (die positive Protonen überwiegt somit). Je nach Anzahl der fehlenden Elektronen werden dann als Exponent (Hochzahl hinter dem Elementssymbol) mit der jeweiligen Ladung angezeigt. Ein Chlorion heißt dann beispielsweise als sogenanntes Anion (negativ geladenes Ion, da die negative Ladung der Elektronen überwiegt) , denn das Chlor-Ion hat 1 Elektron mehr. Eine positive Ladung tritt beispielsweise bei ionischen Metallen auf, zum Beispiel das Kaliumion (), welches 1 Elektron abgegeben hat.

Aufgrund der somit entstehenden verschiedenen Ladungen (Plus und Minus), die sich wie auch bei einem Magneten, gegenseitig anziehen, treten bei den Ionenbindungen immer 2 Formen der Ionen auf, nämlich Anionen (negativ geladen) und Kationen (Positive Ladung), die immer gemeinsam vorkommen, da schließlich mit den abgegebenen Elektronen etwas geschehen muss, bzw. die aufgenommen von irgendwoher stammen müssen. Durch diese elektrostatischen Aufladungen der Teilchen (Ionen können übrigens auch bei Molekülen entstehen, wenn z.B. jeweils ein Elektron von gleichartigen Elementen innerhalb des Moleküls abgegeben wird und diese von einem anderen Stoff aufgenommen werden, dem zu einer abgeschlossenen äußeren Elektronenhülle noch dieselbe Anzahl an Elektronen fehlt.) entsteht nun das sogenannte Ionengitter. Die Ionen ordnen sich, weil Plus immer zu Minus "möchte" und anders herum, wie auf einem Schachbrett an, nur in einem dreidimensionalen Raum. Als Beispiel für die Bildung von Ionen noch einmal folgendes: Es liegen die Elemente Natrium (Na) und Chlor (Cl) vor. Natrium steht in der ersten Hauptgruppe und hat somit nur ein Elektron auf der äußeren Schale. Chlor hat auf der Außenschale 7 Elektronen (VII. HG), ihm fehlt somit eines. Da bei den beiden Elementen Δ EN=2,83-1,01=1,82 ist, ziehen die Chloratome stärker an dem einzigen außenschaligen Elektron des Natriums als das Natrium selbst. Und zwar zieht das Chloratom so stark, dass das (in seiner Schale passenderweise fehlende) Elektron des Natriums in seine Elektronenschale "einfließt". Somit haben beide Stoffe eine abgeschlossene äußere Elektronenhülle und es sind die Ionen und entstanden, die nun ein Ionengitter bilden. Das ganze "Konstrukt" findet sich ganz sicher in jeder Küche und nennt sich Kochsalz.
Van-Der-Waals-Bindung
[Bearbeiten]......
Innermolekulare Kräfte
[Bearbeiten]Damit es innerhalb und zwischen den einzelnen Molekülen zu Zusammenhalt kommt, sind selbstverständlich bestimmte Kräfte notwendig, die die einzelnen Moleküle beieinander bleiben lassen, bzw. dazu beitragen, dass ein "Molekülgerüst" entsteht. Diese Kräfte haben in der Chemie selbstverständlich auch Namen und sollen nun folgend erläutert werden:
Wasserstoffbrücken
[Bearbeiten]Zunächst einmal gibt es die Wasserstoffbrückenbindungen. Das Wort mag zwar vielleicht kompliziert klingen, jedoch werden damit

lediglich die Kräfte betitelt, die bei polaren Stoffen (zur Erinnerung: 0,4 < Δ EN < 1,7 => die Elektronen verschieben sich etwas zu dem elektronegativeren Bindungspartner hin) auftreten, wenn zwischen δ+ ("delta plus" bedeutet, dass eine positive Teilladung Vorliegt, δ- steht also für negative Teilladung, die bei dem elektronegativeren Bindungspartner auftritt) des einen Moleküls und δ- eines anderen Moleküls aufgrund der Tatsache, dass sich auch hier wieder "Gegensätze anziehen", Verbindungen entstehen.
Dieser Effekt tritt oft im Zusammenhang mit Wasserstoff () auf, daher der Name. Als Beispiel wäre u.a. Wasser zu nennen, bei dem Sauerstoff den elektronegativeren Bindungspartner (=> δ-) darstellt und Brücken zwischen den Wasserstoffatomen und den Sauerstoffatomen verschiedener Wassermoleküle bilden lässt (im Bild als rote Striche dargestellt).
Van-der-Waals-Kräfte
[Bearbeiten]Die nächsten wichtigen Wirkungskräfte sind die sogenannten (nach ihrem Entdecker benannten) Van-Der-Waals-Kräfte. Zunächst einmal muss festgehalten werden, dass diese Kräfte wesentlich weniger "stark" bzw. fest sind als die bereits erwähnten Wasserstoffbrücken. Jedes Atom besteht aus dem Kern und den Elektronen, die sich in Schalen um den Kern bewegen. Die Gesamtheit der Elektronen nennt sich Elektronenwolke. Wie es in der Natur so ist, sind selbstverständlich nicht alle Elektronen, wie einem ein Lehrbuch manchmal vorzugaukeln versucht, perfekt um den Atomkern verteilt. Mit den schnellen Bewegungen kann es spontan auftretende Verschiebungen geben, sodass sich die Elektronenwolke manchmal etwas weiter links - und manchmal etwas weiter rechts befindet. Und genau das ist die Ursache der Van-Der-Waals-Kräfte: bei eigentlich unpolaren Stoffen (bei denen Δ EN nur sehr klein ist) ergeben sich somit sogenannte "spontane Dipole". - Dipole sind einfach nur Stoffe, die aufgrund einer solchen Verschiebung der Elektronenwolke auf der einen Seite mehr Elektronen haben als auf der anderen und somit auf dieser Seite elektrisch "negativer" geladen sind (, denn Elektronen sind negative Ladungsträger). Durch diese "spontanen Dipole" verschieben sich auch die Elektronen der umliegenden Atome leicht nach rechts bzw. nach links, sodass eine weitere Verschiebung der Tendenz auftritt. Durch die Zufälligkeit der Verteilung ändert sich dieser Zustand wieder sehr schnell und eine ziemlich ausgewogene - oder zur anderen Seite verschobene - Elektronenwolke entsteht.
Disulfidbrücken
[Bearbeiten]...
Aggregatzustände
[Bearbeiten]Unter Aggregatzustand versteht man die unterschiedlichen Erscheinungsformen von Stoffen, die von Druck und Temperatur abhängig sind.
Fest
[Bearbeiten]Bei Feststoffen sind die einzelnen Teilchen nur sehr wenig in Bewegung und bilden im Verbund meistens Gitterstrukturen aus. Je mehr Energie dem Stoff zugeführt wird (in Form von Wärme) oder je weiter der Druck absinkt, desto stärker bewegen sich die Teilchen. Sobald sich die Teilchen so stark bewegen, dass die zwischenmolekularen Kräfte (=Intermolekulare Kräfte) nicht mehr ausreichen um die Struktur aufrecht zu erhalten, schmilzt der Stoff (->wird flüssig). Umgekehrt wird dieser Vorgang als "erstarren" bezeichnet (flüssig zu fest).
Normalerweise liegt zwischen der festen und gasförmigen Phase noch die flüssige. Jedoch gibt es einige Stoffe, die direkt vom festen in den gasförmigen Zustand (Sublimierung) oder direkt vom gasförmigen in den festen Zustand (zu einem Feststoff kondensieren) übergehen können.
Flüssig
[Bearbeiten]Bei flüssigen Stoffen (wie oben genannt, ist dies abhängig von der Energie, die einem Stoff zugeführt wurde) wirken schwächere Kräfte, als bei Feststoffen. Diese sind die sog. Kohäsionskräfte (= Zusammenhaltskräfte). Im Gegensatz zu Feststoffen sind in Flüssigkeiten die Teilchen nicht ortsfest, d.h. sie sind ständig in Bewegung und stoßen ständig zusammen. Je höher die Temperatur, desto schneller bewegen sich die Teilchen. Wenn die Bewegungen zu stark werden, geht der Stoff in den gasförmigen Zustand über (verdunsten/verdampfen).
Gasig
[Bearbeiten]In gasigen Stoffen sind alle Teilchen so schnell in Bewegung und stoßen sich gegeneinander so stark an, dass sie nicht mehr durch die intermolekularen Kräfte zusammengehalten werden können, einen größeren Raum einnehmen, als in der festen oder flüssigen Phase und die meiste Zeit weit entfernt voneinander sind. Durch diese schnellen Bewegungen verteilen sich gasige Stoffe sehr schnell in einem Raum. Physikalische Eigenschaften von Gasen (Gewicht, Molmasse, usw.) lassen sich oft sehr einfach durch Experimente ermitteln, da man durch das Modell eines idealen Gases immer annehmen kann, dass 1 Mol eines Gases bei Normalbedingungen (0°C, 101,325 kPa) ein Volumen von ~22,41 l hat und unter Standardbedingungen (25°C, 101,325 kPa) ein Volumen von ~24,4 l.
Übungen zum Kurs:Periodensystem und Atome
[Bearbeiten]Zur selbstständigen Überprüfung der erworbenen Kenntnisse zum Thema Periodensystem und Atome folgen nun einige Aufgaben (mit Lösungen).
- Beschreiben Sie anhand eines weiteren Modells den Aufbau aller Stoffe (Atome, Moleküle, Stoff, Protonen, Neutronen, Elektronen).
- Das Element mit der Nummer 14 heißt Silicium(Si). Beschreiben und skizzieren Sie den Aufbau des Moleküls im Bezug auf Nukleonen und Elektronenhülle.















