Kurs:Strukturformeln
|
|
|
Einleitung
[Bearbeiten]
In diesem Kurs sollst du lernen, wie man Strukturformeln korrekt malt und wie man auch komplizierte Verbindungen übersichtlich darstellt, ohne dabei wichtige Informationen wegzulassen oder überflüssige in die Formel einzubauen. Ein gutes Beispiel für eine Strukturformel siehst du auf der rechten Seite. Dort ist ist die Skelettformel von Tryptophan dargestellt. Tryptophan ist eine essentielle Aminosäure, die wir jeden Tag über die Nahrung zu uns nehmen und die für unseren Körper überlebenswichtig ist. Zum Tryptophan kommen wir zum Schluss noch einmal. Wenn du jetzt noch nicht jedes Detail in dieser Strukturformel verstehst, ist das kein Problem. Am Ende des Kurses wirst du so eine Formel mit Leichtigkeit malen können. Aber eins nach dem anderen.
Valenzstrichformeln
[Bearbeiten]Fangen wir mit einem einfachen Beispiel an: dem Butan. Butan ist ein Kohlenwasserstoff, genauer gesagt ein Alkan. Kohlenwasserstoffe haben alle gemeinsam, dass sie nur aus, wie der Name schon sagt, Kohlenstoff und Wasserstoff bestehen. Eine mögliche Darstellung für Butan ist folgende Valenzstrichformel:
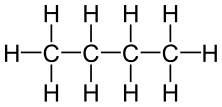
Jedes Kohlenstoffatom ist vierbindig, d. h. jedes Kohlenstoffatom ist mit je einer Einfachbindung (ein Elektronenpaar) mit vier anderen Atomen verbunden. Das sieht man deutlich in folgender Darstellung:

So sind beispielsweise an das zweite C-Atom an Position 1 und 3 ein Wasserstoffatom und an Position 2 und 4 ein Kohlenstoffatom gebunden. Eine weitere Möglichkeit der Darstellung wäre folgende verkürzte Schreibweise:

Die Wasserstoffatome werden hier für jedes C-Atom zusammengefasst.
Chemisch gesehen sind beide Varianten nicht falsch. Sie haben aber beide einen großen Nachteil: Alle C-Atome befinden sich in einer Linie und das entspricht nicht der Wirklichkeit. Ebenso könnte man meinen, dass das gesamte Butan-Molekül in einer Ebene liegt und alle Bindungen im 90°-Winkel zueinander stehen. Auch das ist in der Realität nicht der Fall.
Skelettformeln
[Bearbeiten]Durch Untersuchungen von organischen Verbindungen mittels Röntgenstrukturanalyse kann man die tatsächliche räumliche Struktur von Molekülen ermitteln. Man bekommt dann diese 3D-Struktur heraus:

Und wie du siehst, ist Butan nicht linear, sondern gewinkelt. Und die hier weiß dargestellten H-Atome stehen ebenfalls nicht einfach nur oben und unten von den C-Atomen ab, sondern sind gewinkelt angeordnet.

Sowohl die C-Atome im Zickzack als auch die gewinkelten nach vorn und nach hinten stehenden H-Atome haben einen ganz bestimmten Winkel zueinander, der ungefähr 109,5° beträgt. Diesen Winkel nennt man Tetraederwinkel, weil die Atome wie die Ecken in einem Tetraeder, einem Körper mit vier dreieckigen Seitenflächen, angeordnet sind. In der Mitte dieses Tetraeders befindet sich ebenfalls ein Atom, nämlich ein Kohlenstoffatom, das an alle in den Ecken befindlichen Atome gebunden ist. Ein C-Atom in der Mitte, vier daran gebundene H- oder C-Atome in den Ecken des Tetraeders. Hier erkennst du wieder die Vierbindigkeit des C-Atoms.
Auch wenn du auf dem Papier keine dreidimensionale Struktur malen kannst, solltest du eine Kohlenwasserstoffkette wie Butan in der 2D-Darstellung auf dem Papier als Zickzack darstellen. Das kommt der wirklichen Struktur am nächsten und sieht dann so aus:

Einen Haken hat diese Darstellung leider noch: Sie ist ziemlich unübersichtlich. Die ganze Strukturformel ist überladen mit den Elementsymbolen C und H und man erkennt nicht auf den ersten Blick, wie lang eigentlich die Kette ist und was wirklich alles an den C-Atomen hängt. Mal ist es ein H-Atom, mal ist es eine CH3-Gruppe (Methylgruppe) Um schließlich zur Skelettformel zu kommen, werden einfach alle H-Atome samt der Bindungen zu den H-Atomen weggelassen. Der Buchstabe C wird ebenfalls überall weggelassen. Einzig und allein die Bindungen zwischen den C-Atomen bleiben noch übrig.

So wird die Strukturformel bedeutend übersichtlicher. Man erkennt schnell, dass es eine Kette aus vier C-Atomen ist (die C-Atome sind über drei Bindungen miteinander verbunden). Und diese Schreibweise hat einen weiteren Vorteil. Den bemerkst du, wenn du das Molekül selbst auf ein Blatt Papier malst. Es geht schneller! Fix eine Zickzack-Linie malen und schon hat man ein fertiges Butan-Molekül auf dem Papier. Die H-Atome denkt man sich einfach dazu, indem man immer im Hinterkopf behält, dass das C-Atom vierbindig ist. Gehen vom C-Atom in der Skelettformel zwei andere Bindungen zu zwei anderen C-Atomen, so müssen noch zwei H-Atome an dieses C-Atom gebunden sein. Du musst einfach immer gedanklich jedes C-Atom mit H-Atomen bis zur Vierbindigkeit auffüllen.
Funktionelle Gruppen
[Bearbeiten]Beim Butan ist das vielleicht noch recht übersichtlich, wenn man nicht die Skelettschreibweise benutzt, aber bei großen Molekülen mit funktionellen Gruppen, ist es wichtig, auf den ersten Blick zu sehen, wo welche funktionelle Gruppe ist. Das heißt aber nicht, dass du nicht die Skelettformeln auch bei kleinen, einfachen Molekülen wie Butan verwenden solltest.
Schau dir zum Beispiel diese Valenzstrichformel der Milchsäure an:

Und jetzt lassen wir wieder alle H-Atome und die dazugehörigen Bindungen weg und die Cs ebenso.
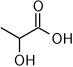
Das sieht schon viel übersichtlicher aus. Aber dir könnte aufgefallen sein, dass wir die zwei H-Atome an den zwei OH-Gruppen stehen gelassen haben. Das liegt daran, dass dies zwei funktionelle Gruppen sind, links die OH-Gruppe (eine Hydroxylgruppe) und rechts die COOH-Gruppe (eine Carboxylgruppe), das C-Atom mit der Doppelbindung zum O gehört hier zur funktionellen Gruppe dazu. Zwar könnte man davon ausgehen, dass Sauerstoff als Element aus der sechsten Hauptgruppe des Periodensystems zweibindig ist und man zählt das fehlende H einfach dazu, um laut der Oktettregel auf acht Außenelektronen zu kommen (2 Elektronenpaare für die 2 Bindungen macht 4 Elektronen plus 2 freie Elektronenpaare am Sauerstoffatom, die hier nicht eingezeichnet sind = 8 Außenelektronen), aber funktionelle Gruppen sind außerordentlich wichtig für chemische Reaktionen. Hier geht oft ein H-Atom ab oder ein extra H-Atom dran. Deswegen geht man Missverständnissen aus dem Weg und malt das H-Atom, wenn es denn gerade an das O gebunden ist, dazu.
An den funktionellen Gruppen finden die meisten chemische Reaktionen statt. Das Kohlenwasserstoffgerüst spielt dabei meist nur eine untergeordnete Rolle. Man kann sich die C- und H-Atome als das Gerüst oder das Skelett des Moleküls vorstellen, das Rückgrat der funktionellen Gruppen. Und hier merkst du, warum man außerdem Skelett- bzw. Gerüstformeln malen sollte. Sie heben die wichtigen funktionellen Gruppen hervor und lassen das unreaktive Gerüst in den Hintergrund rücken. Mit der Darstellung erkennst du schneller, worauf es bei einer chemischen Reaktion ankommt.

Kommen wir nun zu unserem eingangs erwähnten Beispiel, dem Tryptophan. Schau dir die Valenzstrichformel und die Skelettformel an. Hier siehst du sofort, dass man auf keinen Fall C- und H-Atome ausschreiben sollte. Die Valenzstrichformel ist völlig unübersichtlich, man erkennt nicht einmal auf Anhieb den Sechs- oder den Fünfring. Ebenso geht der Stickstoff als Teil einer funktionellen Gruppe im Fünfring total unter. Schauen wir uns noch einmal die Skelettformel genauer an:

Da das Element Stickstoff in der fünften Hauptgruppe des Periodensystems steht, ist es im ungeladenen Zustand dreibindig. Damit es auf sein Elektronenoktett aus acht Außenelektronen kommt, geht es drei Einfachbindungen ein (3 Elektronenpaare = 6 Elektronen). Mit einem hier nicht eingezeichneten freien Elektronenpaar am Stickstoffatom kommt es somit tatsächlich auf acht Außenelektronen. Trotzdem malt man das H-Atom bei allen Nicht-C-Atomen (man nennt diese Atome in der organischen Chemie Heteroatome) mit, da es hier bei Reaktionen oft vorkommt, dass ein H abgeht oder ein zusätzliches rangeht. Es gilt also das selbe wie beim oben erwähnten Sauerstoff. Somit gibt es keine Missverständnisse bei der Frage, ob nun das H-Atom implizit dran ist oder nicht.

Und noch etwas könnte dir aufgefallen sein: Die Bindung zur rechten NH2-Gruppe (Aminogruppe) am Alkylrest (der „Zickzack-Rest“) ist als Keil gemalt. Ein ausgemalter Keil bedeutet, dass die Gruppe nach vorn zeigt, also in deine Richtung aus dem Bildschirm heraus. In der Valenzstrichformel siehst du auch das H-Atom, das nach hinten zeigt. Dies wird durch einen gestrichelten Keil gekennzeichnet. Falls du dir das noch nicht räumlich vorstellen kann, schau dir auf der rechten Seite die 3D-Struktur von Tryptophan an. Im rechten Teil des Moleküls siehst du das blau eingemalte Stickstoffatom mit den zwei daran gebundenen Wasserstoffatomen, das in deine Richtung schaut. Das einzelne weiße H-Atom, das an das selbe C-Atom gebunden ist wie die NH2-Gruppe, zeigt dagegen nach hinten von dir weg. Man spricht bei der obigen Art der Darstellung mit Keilen auch von Keilstrichformeln.
Zusammenfassung
[Bearbeiten]Folgende Punkte solltest du dir merken:
|
Merke:
|
Du beherrschst jetzt etwas außerordentlich Wichtiges. Das, was du in diesem Kurs gelernt hast, ist die Grundlage für alle Dinge aus der organischen Chemie, die du in der Schule, im Studium oder in deinem Leben als Chemiker noch lernen wirst. Das wichtigste Kommunikationsmittel in der organischen Chemie sind klare und verständliche Strukturformeln. Auch im Organik-Bereich der Wikiversity wirst du immer auf Skelett- bzw. Keilstrichformeln angewiesen sein. Aber nicht nur wir befolgen die oben genannten Regeln. Auch du solltest immer darauf achten, dass du Strukturformeln richtig malst. Bevor du jemals wieder ein C oder ein H schreibst, überlege dir noch einmal genau, ob das in deinem Fall wirklich notwendig ist.
Weiterführende Literatur
[Bearbeiten]- J. Clayden, N. Greeves, S. Warren: Organic Chemistry, Oxford University Press, Oxford, 2. Aufl., 2012, ISBN 978-0199270293, S. 15-22.


